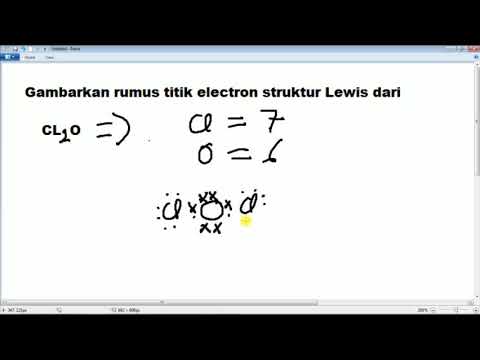
Isi
Struktur dot elektron, juga disebut struktur Lewis, adalah representasi grafis dari cara elektron didistribusikan ke seluruh senyawa. Setiap elemen simbol kimia dikelilingi oleh garis-garis, mewakili ikatan, dan titik-titik, mewakili elektron yang tidak terikat. Saat menggambar struktur elektron, tujuan Anda adalah membuat setiap elemen valensi, atau kulit elektron terluar, semaksimal mungkin, tanpa melampaui jumlah maksimum elektron untuk kulit itu.
Tentukan setiap elemen dalam struktur dengan melihat rumus kimianya. Misalnya, rumus karbon dioksida adalah CO2. Karena itu ia memiliki satu atom karbon dan dua atom oksigen.
Cari setiap elemen di Tabel Periodik. Catat setiap grup, atau nomor kolom. Ini mencerminkan berapa banyak elektron valensi yang dimiliki elemen. Misalnya, karbon dalam kelompok 4A dan oksigen dalam kelompok 6A; karena itu karbon memiliki empat elektron valensi dan oksigen memiliki enam.
Tambahkan elektron valensi semua elemen. Ini adalah jumlah total elektron yang tersedia untuk struktur titik. Karena 4 + 6 + 6 = 16, akan ada 16 elektron dalam struktur karbon dioksida Lewis.
Tentukan elemen mana yang paling sedikit elektronegatif, atau memiliki tarikan terlemah pada elektron, dengan melihat grafik elektronegativitas atau dengan memeriksa posisi elemen relatif terhadap elemen lain pada Tabel Periodik. Unsur-unsur umumnya meningkatkan elektronegativitas dari kiri ke kanan dan dari bawah ke atas. Karbon adalah unsur paling elektronegatif dalam senyawa, dengan nilai 2,5.
Tempatkan elemen paling tidak elektronegatif di tengah struktur, lalu kelilingi dengan atom lainnya. Hidrogen cenderung menjadi pengecualian untuk aturan ini dan jarang merupakan atom pusat. Struktur karbon dioksida akan dimulai seperti ini: O C O.
Gambarlah garis lurus antara setiap atom terluar dan atom pusat untuk mewakili ikatan tunggal. Misalnya, O - C - O.
Kurangi jumlah total elektron ikatan dari jumlah elektron yang tersedia. Ingatlah bahwa setiap ikatan tunggal melibatkan dua elektron. Karena ada dua ikatan yang masing-masing mengandung dua elektron, ada 12 lebih banyak elektron yang tersedia untuk struktur karbon dioksida.
Tempatkan titik-titik untuk mewakili elektron yang tersisa di sekitar masing-masing atom terluar hingga kulit valensinya penuh. Hidrogen membutuhkan dua elektron dan non-logam biasanya membutuhkan delapan.
Tambahkan sisa elektron ke atom pusat. Jika tidak ada elektron yang tersisa, namun atom pusat memiliki lebih sedikit elektron daripada yang dimulai, ini menunjukkan bahwa strukturnya belum selesai. Sebagai contoh, karbon hanya menyumbang satu elektron untuk setiap pasangan yang terikat. Ada dua pasangan terikat, sehingga menyumbang dua elektron. Namun karbon memiliki empat elektron valensi. Diagram membutuhkan kerja tambahan.
Buat ikatan rangkap atau rangkap tiga antara atom pusat dan atom terluar jika kulit atom valensi pusat tidak penuh dan pasangan elektron yang tidak terikat berada di dekatnya.
Jika elektron adalah ion, tambahkan atau kurangi jumlah elektron yang ditunjukkan oleh muatan dari pasangan yang tidak terikat.
Tulis muatan yang sama dengan jumlah elektron yang Anda tambahkan atau kurangi di sebelah setiap elemen yang terpengaruh.