Isi
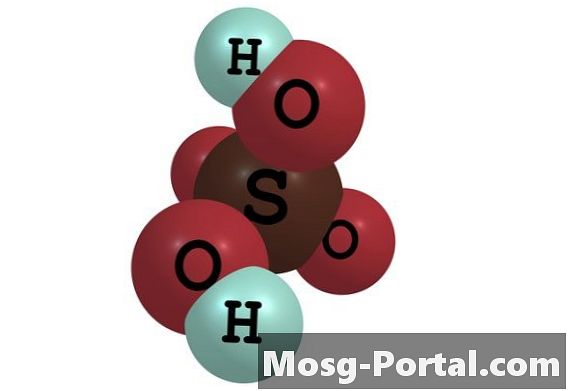
Asam sulfat adalah asam anorganik kuat yang biasa digunakan dalam produksi industri bahan kimia, dalam pekerjaan penelitian dan dalam pengaturan laboratorium. Ini memiliki rumus molekul H2SO4. Ini larut dalam air pada semua konsentrasi untuk membentuk larutan asam sulfat. Dalam larutan, satu mol asam sulfat terpisah menjadi satu mol ion sulfat bermuatan negatif, atau SO4 (2-), dan 2 mol ion hidronium bermuatan positif, atau H3O +. Konsentrasi ion-ion ini dinyatakan dalam molaritas, yang didefinisikan sebagai jumlah mol ion per liter larutan. Konsentrasi mereka tergantung pada konsentrasi awal asam sulfat.