
Isi
- TL; DR (Terlalu Panjang; Tidak Dibaca)
- Cara Menghitung Tahi Lalat
- Konversi ke Mmol
- Konsentrasi Solusi
- Contoh
Untuk sekadar perhitungan mereka, ahli kimia menciptakan unit standar untuk jumlah atom suatu senyawa tertentu yang terlibat dalam suatu reaksi atau proses kimia lainnya. Mereka mendefinisikan satu mol (mol) sebagai jumlah zat apa pun yang memiliki jumlah unit dasar yang sama dengan 12 gram karbon-12, yaitu nomor Avogadros (6.022 × 1023). Sistem pengukuran SI (metrik) mendefinisikan milimol (Mmol) sebagai seperseribu mol. Anda biasanya menghitung jumlah mol suatu zat dengan menimbang jumlah yang Anda miliki. Jika Anda ingin mengonversi ke Mmol, kalikan dengan 103 (1,000).
TL; DR (Terlalu Panjang; Tidak Dibaca)
Satu mol sama dengan jumlah partikel Avogadros dari senyawa tertentu. Satu milimol (Mmol) adalah seperseribu mol.
Cara Menghitung Tahi Lalat
Massa atom diukur dalam satuan massa atom (AMU). Satu AMU persis 1/12 massa inti atom karbon-12 dalam kondisi dasarnya. Satu mol zat didefinisikan sama dengan jumlah partikel Avogadros dari zat itu. Menurut definisi ini, berat satu mol suatu zat dalam gram adalah angka yang sama dengan berat partikel individu dari zat itu dalam AMU. Misalnya, berat atom karbon-12 adalah 12 AMU, jadi satu mol karbon-12 memiliki berat 12 gram.
Pertimbangkan wadah yang penuh dengan gas hidrogen (H2). Setiap partikel dalam wadah adalah molekul yang terdiri dari dua atom hidrogen, jadi Anda hanya perlu mengetahui massa atom hidrogen untuk menghitung berat molekul. Sebagian besar versi tabel periodik mencantumkan massa atom setiap elemen di bawah simbolnya. Untuk hidrogen, yang memiliki satu proton dalam nukleusnya, yaitu 1,008 AMU, yang merupakan rata-rata dari semua isotop hidrogen yang terjadi secara alami. Akibatnya, massa atom gas hidrogen adalah 2,016 AMU, dan satu mol gas hidrogen beratnya 2,016 gram. Untuk menemukan jumlah mol dalam sampel Anda, Anda akan menimbang sampel dalam gram dan membaginya dengan berat molekul gas hidrogen dalam gram. Misalnya, sampel dengan berat 15 gram gas hidrogen murni mengandung 7,44 mol.
Konversi ke Mmol
Terkadang jumlah yang diselidiki sangat kecil sehingga mengungkapkannya dalam mol adalah rumit. Masukkan milimol. Dengan mengalikan jumlah mol dengan seribu, Anda dapat mengonversi jumlah yang sangat kecil ke yang lebih mudah dikelola. Ini sangat nyaman ketika berhadapan dengan unit volume dalam urutan mililiter.
1 mol = 1.000 Mmol
Konsentrasi Solusi
Kimiawan menggunakan molaritas sebagai ukuran konsentrasi senyawa tertentu dalam larutan. Mereka mendefinisikan molaritas sebagai jumlah mol per liter. Anda mengonversi molaritas menjadi milimolaritas dengan mengalikannya dengan 1.000. Misalnya, larutan 1 mol (molar, juga ditulis sebagai M) memiliki konsentrasi 1 mol per liter. Ini setara dengan solusi 1.000 Mmol (milimolar, juga kadang-kadang ditulis sebagai mM), yang merupakan solusi yang mengandung 1.000 Mmol per liter.
Contoh
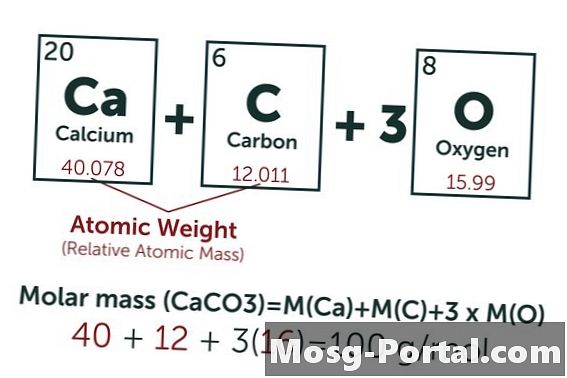
Suatu larutan mengandung 0,15 gram kalsium karbonat. Berapa milimolnya?
Formula kimia kalsium karbonat adalah CaCO3. Berat atom karbon (C) adalah sekitar 12 AMU, yaitu oksigen (O) sekitar 16 AMU dan kalsium (Ca) sekitar 40 AMU. Setiap molekul kalsium karbonat dengan demikian memiliki berat 100 AMU, yang berarti satu mol memiliki berat sekitar 100 gram. Berat 0,15 gram mewakili 0,15 g ÷ 100 g / mol = 0,0015 mol. Ini setara dengan 1,5 Mmol.
Berapa molaritas dan milimolaritas dari banyak kalsium karbonat ini dalam 2,5 liter larutan?
Molaritas didefinisikan sebagai jumlah mol per liter, jadi bagi jumlah mol dengan 2,5 untuk mendapatkan molaritas: 0,0015 ÷ 2,5 =
0,0006 M
Kalikan dengan 1.000 untuk mendapatkan milimolaritas =
0,6 mM
Perhatikan bahwa Anda tiba pada hasil yang sama untuk milimolaritas jika Anda membagi jumlah milimol dengan volume larutan.